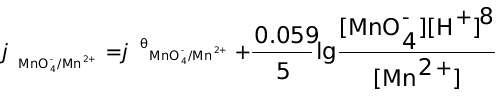相关题目
4、测定某钛矿中 TiO2 的质量分数,6次分析结果的平均值为 58.66%,s = 0.07 %,求:(1)总体平均值 的置信区间;(2)如果测定三次,置信区间又为多少?上述计算结果说明了什么问题?(P = 95%)已知:P = 95%, n = 6时, t0.05 , 5 = 2.57; n = 3时,t0.05 , 2 = 4.30。
的置信区间;(2)如果测定三次,置信区间又为多少?上述计算结果说明了什么问题?(P = 95%)已知:P = 95%, n = 6时, t0.05 , 5 = 2.57; n = 3时,t0.05 , 2 = 4.30。
解:(1) n = 6 , t0.05 , 5 = 2.57,根据置信区间计算公式,有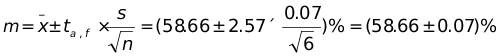
(2) n = 3, 设 t0.05 , 2 = 4.30,根据置信区间计算公式,有
t0.05 , 2 = 4.30,根据置信区间计算公式,有
计算结果表明,在相同的置信度下,测定次数多比测定次数少的置信区间要小,即所估计的真值可能存在的范围较小,说明平均值更接近真值。
3、标定NaOH,分析结果(mol/L):0.1012,0.1014,0.1025,0.1016,计算:(1)平均值;(2)相对平均偏差;(3)标准偏差及平均值在置信度为90%时的置信区间。已知: P=90%,t=2.35。
解:(1)平均值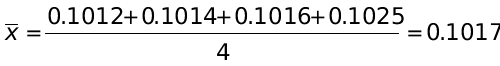 mol/L
mol/L
(2)相对均差 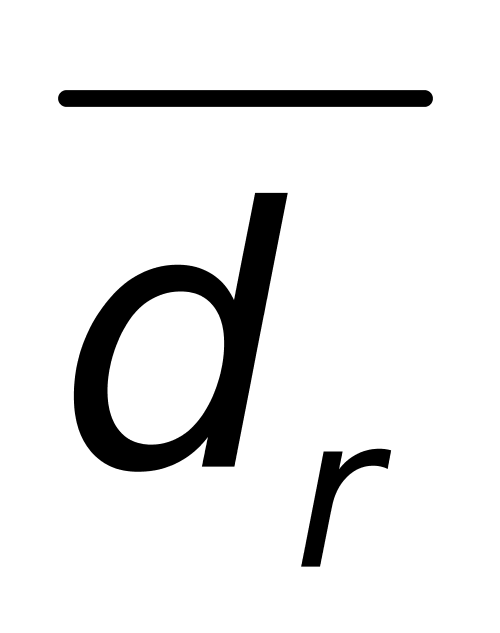 =
=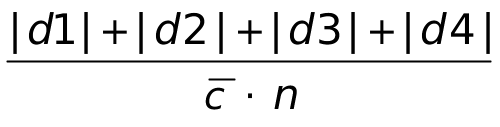 ×100% =
×100% =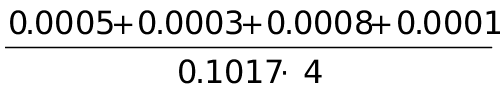 ×100%=0.42%
×100%=0.42%
(3)s =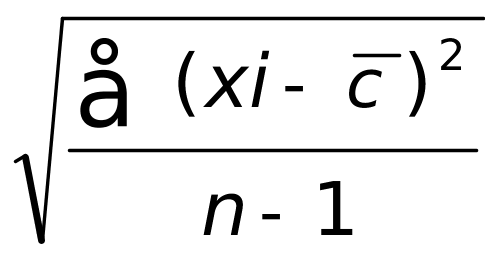 =5.7×10-4
=5.7×10-4
μ = x ±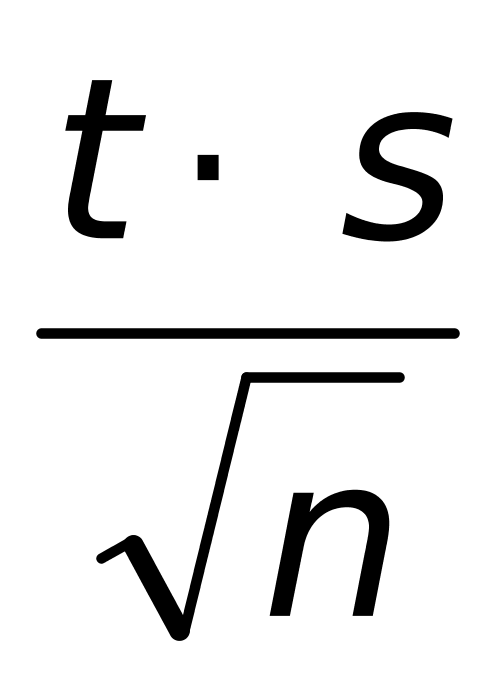 = 0.1017±
= 0.1017±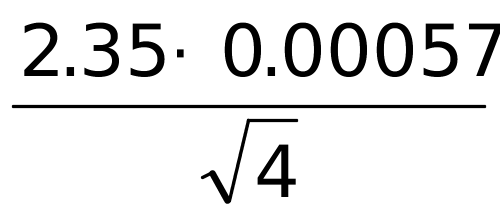 =(0.1017±0.0007 )mol/L
=(0.1017±0.0007 )mol/L
2、某铁矿石中含铁39.16%,若甲分析得结果为39.12%,39.15%和39.18%,乙分析得39.19%,39.24%和39.28%。计算较甲、乙两人分析结果的平均值、绝对误差、相对误差、平均偏差、标准偏差,并根据甲、乙两人分析结果的准确度和精密度评价测定结果。(本题13分)
解: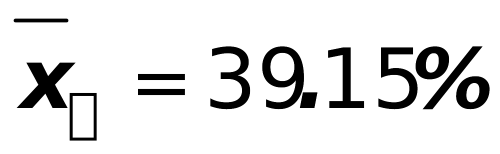 ;
;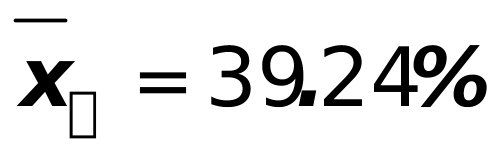
1、三次标定NaOH溶液浓度(mol∙L-1)结果为0.2085、0.2083、0.2086,计算测定结果的平均值、个别测定值的平均偏差、相对平均偏差、标准差和相对标准偏差。
解: 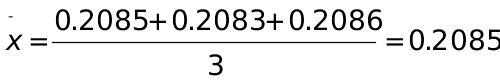 (mol∙L-1)
(mol∙L-1)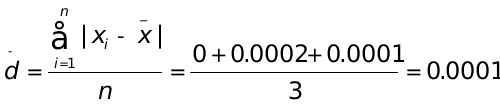 (mol∙L-1)
(mol∙L-1)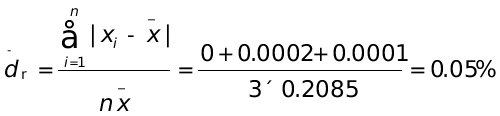
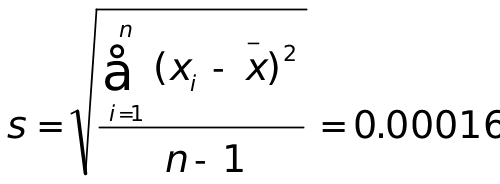 (mol∙L-1)
(mol∙L-1)
2、有两位学生使用相同的分析仪器标定某溶液的浓度(mol·L-1),结果如下:
甲:0.20,0.20,0.20(相对平均偏差0.00%);
乙:0.2043,0.2037 ,0.2040(相对平均偏差0.1%)。
如何评价他们的实验结果的准确度和精密度?
4、误差:测定值与真值之差。
简答题
如何减少偶然误差和系统误差?
3、偏差:单次测定结果与平均值之差。
2、精密度:多次测量结果之间的一致程度。
13、( )在计算过程中,为提高计算结果的可靠性,可以暂时多保留一位有效数字。
名词解释
准确度:是测定值与真值接近的程度。
12、( )对某项测定来说,它的系统误差大小是不可测量的。




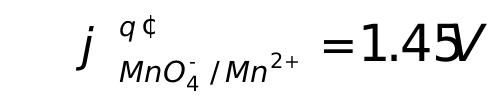 。
。