4、测定某钛矿中 TiO2 的质量分数,6次分析结果的平均值为 58.66%,s = 0.07 %,求:(1)总体平均值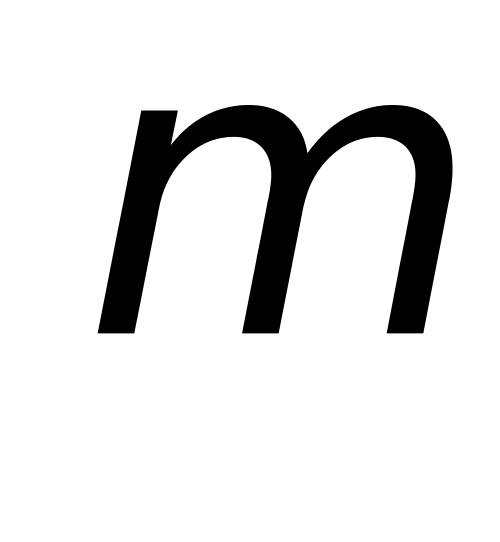 的置信区间;(2)如果测定三次,置信区间又为多少?上述计算结果说明了什么问题?(P = 95%)已知:P = 95%, n = 6时, t0.05 , 5 = 2.57; n = 3时,t0.05 , 2 = 4.30。
的置信区间;(2)如果测定三次,置信区间又为多少?上述计算结果说明了什么问题?(P = 95%)已知:P = 95%, n = 6时, t0.05 , 5 = 2.57; n = 3时,t0.05 , 2 = 4.30。
解:(1) n = 6 , t0.05 , 5 = 2.57,根据置信区间计算公式,有
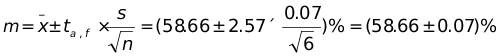
(2) n = 3, 设 t0.05 , 2 = 4.30,根据置信区间计算公式,有
t0.05 , 2 = 4.30,根据置信区间计算公式,有

计算结果表明,在相同的置信度下,测定次数多比测定次数少的置信区间要小,即所估计的真值可能存在的范围较小,说明平均值更接近真值。
答案解析
相关题目
1、计算0.02mol/L KMnO4在1mol/L HClO4溶液中用亚铁盐还原至一半时的电位。已知:在1mol/L HClO4中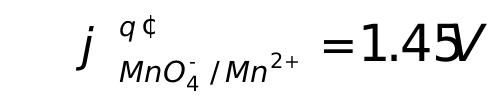 。
。
解:半反应方程为:MnO4 + 8H+ + 5e = Mn2+ + 4H2O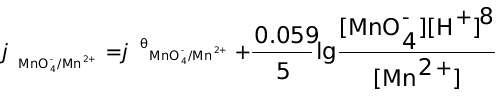

5、某同学如下配制 0.02 mol∙L-1 KMnO4溶液,请指出其错误。
准确称取 1.581g 固体 KMnO4,用煮沸过的蒸馏水溶解,转移至 500 mL 容量瓶,稀释至刻度,然后用干燥的滤纸过滤。
4、用草酸钠标定KMnO4溶液时,温度范围是多少?过高或过低有什么不好?在该实验中能否用HNO3、HCl或HAc来调节溶液的酸度?为什么? 催化剂和指示剂又是什么?
3、简述硫代硫酸钠标准溶液的配制与标定所用基准物、反应的方程式、温度、酸度、滴定速度、所用指示剂及滴加时机。
2、请回答 K2Cr2O7 标定 Na2S2O3时实验中的有关问题。
(1) 为何不采用直接法标定,而采用间接碘量法标定?
(2) Cr2O72-氧化 I-反应为何要加酸,并加盖在暗处放置 5 min,而用Na2S2O3 滴定前又要加蒸馏水稀释?
1、简述高锰酸钾标准溶液的配制;标定所用基准物;反应的方程式;温度;酸度;滴定速度;催化剂及所用指示剂。
13、( )氧化还原滴定反应其化学计量点电势与两电对的条件电势和试剂的浓度有关。
12、( )配制好的Na2S2O3标准溶液应立即用基准物质标定。
11、( )氧化还原电对本身的性质也是影响氧化还原反应速率的因素。
10、( )K2Cr2O7标准溶液非常稳定,可以长期保存。










