7、( )用EDTA测水中钙时,维持pH=12的目的只是为了使水中的镁生成Mg(OH)2沉淀而不被滴定。
答案解析
解析:
相关题目
5、用0.01000mol·L-1HNO3溶液滴定20.00mL 0.01000 mol·L-1NaOH溶液时,化学计量点时pH为多少?化学计量点附近的滴定突跃为多少?应选用何种指示剂指示终点?
解: HNO3 + NaOH → NaNO3 + H2O
化学计量点的pH=7.00
计量点前,加入HNO319.98mL,NaOH剩余0.02mL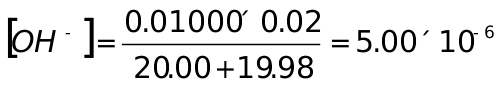
pH=8.70
计量点后,HNO3过量0.02mL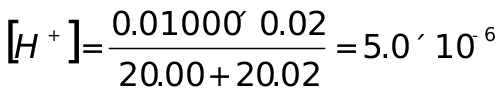
pH=5.30
滴定突跃为8.70-5.30,选中性红(或百里酚蓝或酚红或酚酞)为指示剂。
4、用0.1000 mol·L-1NaOH溶液滴定0.1000 mol·L-1酒石酸溶液时,有几个滴定突跃?在第二化学计量点时,pH为多少?应选用什么指示剂指示终点?已知:酒石酸pKa1=3.04 ,pKa2=4.37。
解: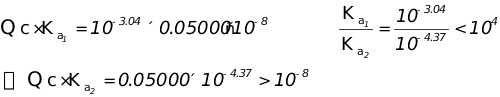
∴酒石酸不能分步滴定,由于第二步能准确滴定,因此只有一个突跃。
第二个化学计量点时 ,酒石酸根离子的浓度为0.03333mol·L-1 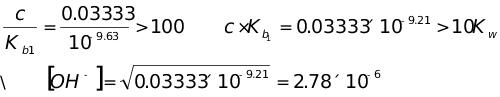
pOH=5.56 pH=8.44
选用百里酚蓝(或中性红或酚酞或酚红)为指示剂。
3、某弱酸pKa = 9.21,现有其共轭碱NaA溶液20.00mL,浓度为0.1000 mol·L-1,当用0.1000 mol·L-1 HCl溶液滴定时,化学计量点的pH值为多少?其附近的滴定突跃为多少?
解:化学计量点时:[H+]=(c×Ka)1/2=(0.05×10-9.21)1/2=10-5.25
pH=5.25
化学计量点前-0.1%时,滴定剂的加入量为19.98mL
[H+]=ca/cb×Ka=19.98/0.02×10-9.21=10-6.21,
pH=6.21
化学计量点后0.1%时,滴定剂的加入量为20.02mL
[H+]=cHCl=0.02×0.01/40.02=5×10-5
pH=4.3
2、用0.1000mol·L-1 HCl标准溶液,滴定0.1000mol·L-1 Na2CO3时,有几个滴定突跃?在化学计量点时pH为多少? 已知:Ka1= 4.17×10-5; Ka2= 5.56×10-9。
因为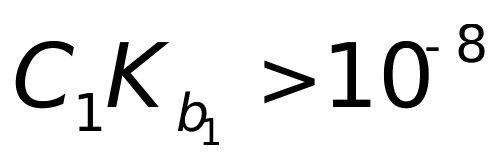 ,
, <10-8
<10-8
并且
有两个滴定突跃,但是第二突跃不明显,准确度不高。
第一化学计量点:产物为HCO3-

第二化学计量点:是CO2的饱和溶液 


4、简述如何用酸碱滴定法判断混合碱的组成。
3、NaOH试剂能否直接准确称取配制标准溶液,为什么?
2、简述滴定分析法对化学反应的要求?
6、终点误差:滴定终点与化学计量点不一致造成的误差。
什么叫滴定分析?它的主要分析方法有哪些?
5、化学计量点:滴加的标准溶液与待测组分恰好反应完全的点。
4、标定:将滴定剂通过滴管滴入待测溶液中的过程。











